LA • Ordnungszahl 57

Lanthan
Lanthan ist ein silberweißes glänzendes Metall, das duktil und sehr reaktiv ist. Es existieren drei metallische Modifikationen. Lanthan ist nach Cer das häufigste der Seltenerdmetalle und gehört zur Gruppe der leichten Seltenen Erden.
Die wichtigste Eigenschaft von Lanthan ist seine ausgeprägte Fähigkeit, Wasserstoff zu absorbieren, was Lanthan zu einem wichtigen Bestandteil in Nickel-Metallhydrid-Akkus (NiMH) macht.
Lanthan wurde 1839 vom schwedischen Chemiker und Chirurg Carl Gustav Mosander entdeckt. Wie die meisten der Seltenerdelemente wurde auch Lanthan zunächst in Form seines Oxids, des sogenannten Ceriumdioxid (Cer(IV)oxid), identifiziert und erst Jahrzehnte nach seiner Entdeckung als reines Metall gewonnen.
Die wirtschaftlich bedeutendsten Mineralien für Lanthan sind Bastnäsit und Monazit. Es wird hauptsächlich in China, den USA (Mountain Pass) und Australien (Mount Weld) gewonnen.
Nach einer aufwendigen Abtrennung der anderen Lanthanbegleiter wird das Oxid mit Fluorwasserstoff zum Lanthanfluorid umgesetzt. Anschließend wird dieses mit Calcium unter Bildung von Calciumfluorid zum Lanthan reduziert. Die Abtrennung verbleibender Calciumreste und Verunreinigungen erfolgt in einer zusätzlichen Umschmelzung im Vakuum.
Die wirtschaftlich bedeutendsten Mineralien für Lanthan sind Bastnäsit und Monazit. Es wird hauptsächlich in China, den USA (Mountain Pass) und Australien (Mount Weld) gewonnen.
Lanthan und Cer sind die beiden häufigsten leichten Seltenen Erden. Sie kommen in großen Mengen in den wirtschaftlich wichtigsten Erzen Bastnäsit und Monazit vor.
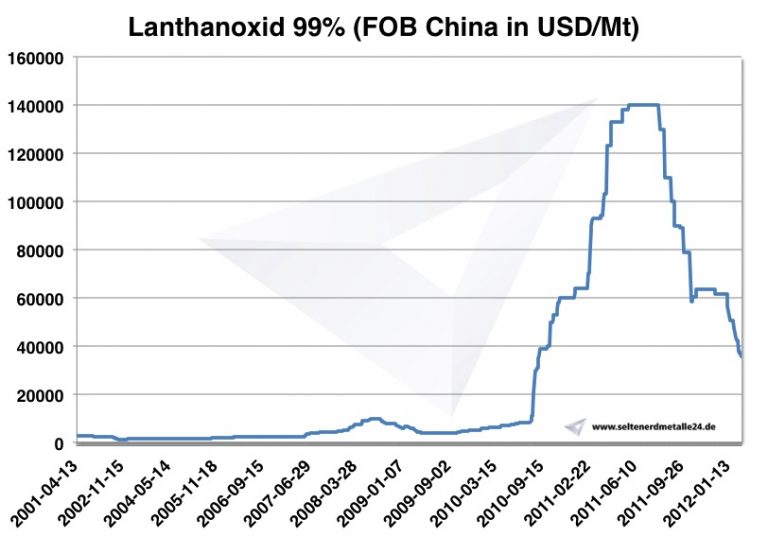
In einer typischen Bastnäsit-Lagerstätte machen Cer und Lanthan zusammen bis zu über 50 Prozent des Gesamtgehalts an Seltenen Erden aus. Deswegen kommt es zu einer erheblichen und anhaltenden Überproduktion von Cer und Lanthan im Verhältnis zur Marktnachfrage vor. Diese Überproduktion ist ein grundlegendes Merkmal der Seltenen-Erden-Branche und wird als "Balance Problem" bezeichnet.
DIe mit Abstand wichtigste Anwendung für Lanthan sind Nickel-Metallhydrid-Akkus (NiMH), wo sie als Lanthan-haltige Legierung die zentrale Komponente der negativen Elektrode (Anode) darstellen. Wiederaufladbare NiMH-Akku waren früher weit verbreitet in Laptops, Kameras und besonders in Hybridfahrzeugen wie dem Toyota Prius.
Lanthan ist mit Cer ein wichtiger Bestandteil von Mischmetall, einer Metallegierung aus Seltenen Erden, deren Zusammensetzung der einzelnen Seltenerdelemente sich aus dem Ausgangsmineral ergibt, sowie Eisen.
Wegen seiner Pyrophorizität, das bedeutet, dass sich feine Späne des Metalls an der Luft bei Reibungshitze selbst entzünden, wird Mischmetall im Zündstein von Feuerzeugen verwendet.
Neben Feuerzeugen dient Mischmetall als Zündmittel für brennbare Gase und explosive Stoffe. Es kommt in Gasanzündern für Haushalts-Gasherde, Gasöfen, Gasheizungen und -durchlauferhitzern vor, in Zünder von Feuerwerk und Pyrotechnik sowie in bestimmten militärischen und industriellen Anwendungen als Treib- und Sprengsatzzündung.
Aufgrund seiner hohen Reaktivität kann Mischmetall in bestimmten metallurgischen Prozessen als Reduktionsmittel eingesetzt werden, um Oxide zu reduzieren.
Mit Cobalt:
Die Cobalt-Lanthan-Legierung LaCo5 wird als Magnetwerkstoff, lanthandotiertes Bariumtitanat zur Herstellung von Kaltleitern (temperaturabhängige Widerstände) verwendet. In Verbindung mit Cobalt, Eisen, Mangan, Strontium u. a. dient es als Kathode für Hochtemperatur-Brennstoffzellen (SOFC). „Verunreinigtes“ Lanthan-Nickel (LaNi5) findet als Wasserstoffspeicher in Nickel-Metallhydrid-Akkumulatoren Verwendung. Als Zusatz kommt es in Kohlelichtbogenlampen zur Studiobeleuchtung und in Filmvorführanlagen (historische Anwendung?) vor.
Mit Titan:
Einem Legierungsmetall mit Materialzusammensetzungen aus Lanthan und Titan wird die Wirkung zugeschrieben, dass bei spanbildender Verarbeitung die Spanlänge reduziert wird. Dadurch soll die Bearbeitung des Metalls erleichtert werden.
Im Bereich der Medizin werden aus dem Legierungsmetall korrosionsbeständige und gut sterilisierbare Instrumente hergestellt. Diese Metalllegierung mit Titan soll für Werkzeuge und Apparate für chirurgische Eingriffe besonders gut geeignet sein, da die Allergie-Neigung bei Verwendung derartiger Metalllegierung mit Titan im Verhältnis zu anderen Legierungen gering sein soll.
Als Lanthanoxid
Herstellung von Gläsern (Lanthanglas) mit vergleichsweise hoher Brechzahl, die sich wiederum nur wenig mit der Wellenlänge ändert (geringe Dispersion), für Kameras, Teleskoplinsen und für Brillengläser
Herstellung von Kristallglas und Porzellanglasuren. Es ersetzt giftigere Bleiverbindungen unter gleichzeitiger Verbesserung der chemischen Beständigkeit (Verbesserung der Laugenbeständigkeit, „spülmaschinenfest“)
Katalysatorzusatz an Zeolithen beim Fluid Catalytic Cracking in der Raffinerie zur Erdölverarbeitung
Herstellung keramischer Kondensatormassen und silikatfreier Gläser
Bestandteil von Glaspoliermitteln
Herstellung von Glühkathoden für Elektronenröhren (auch Lanthanboride)
Als Lanthancarbonat
Medikament zur Senkung des Phosphatspiegels bei Dialysepatienten (sog. Phosphatbinder)
Lanthan wird als wenig toxisch eingestuft. Eine toxische Dosis ist bisher unbekannt. Jedoch gilt Lanthan-Pulver als stark ätzend, weil es sehr leicht durch z.B. Hautfeuchtigkeit zu basischem Lanthanhydroxid reagiert (ähnlich den Elementen Calcium und Strontium). Die letale Dosis beträgt bei Ratten 720 mg.
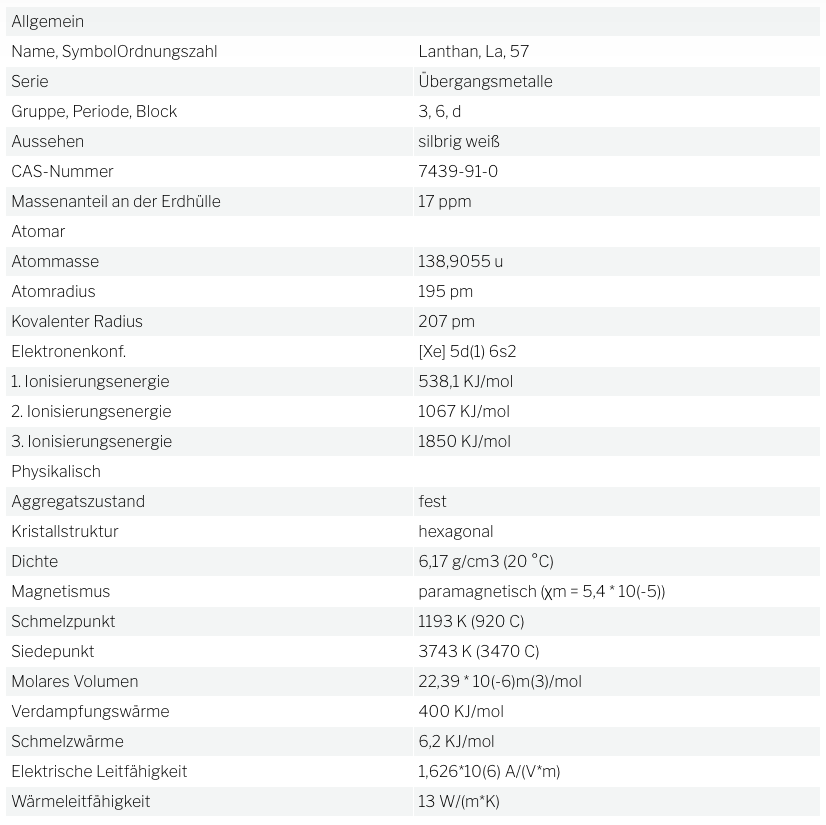
Das silberweiß glänzende Metall ist hämmerbar und duktil. Es existieren drei metallische Modifikationen.
Lanthan ist unedel. Es überzieht sich an der Luft rasch mit einer weißen Oxidschicht, die in feuchter Luft zum Hydroxid weiterreagiert.

